Cập nhật lần cuối vào 06/04/2023
Giới thiệu về công nghệ in 3D
Hiện nay, khái niệm “in 3D”(3D printing) đã trở nên quen thuộc trong nhiều lĩnh vực sản xuất. Cụm từ này còn đồng nghĩa và được sử dụng tương đương với một số cụm từ phổ biến như “in nguyên mẫu nhanh chóng” (rapid prototyping),“tạo vật thể rắn định dạng tự do” (solid free form fabrication) hay “chế tạo bằng cách bồi đắp”(additive manufacturing) [1].
“In 3D” được phát minh vào những năm 1980 và máy in 3D đầu tiên đi vào hoạt động năm 1986 đã thiết lập được nền tảng vững chắc cho công nghệ mới này. Ứng dụng đầu tiên của in 3D trong y tế là việc thử nghiệm tái tạo đầu và cổ đã làm thay đổi một số kỹ thuật cấy ghép hộp sọ vào giữa những năm 1990 [2]. Trong 20 năm đầu tiên, công nghệ in 3D chỉ đạt được những thành tựu nhỏ. Tuy nhiên, đến sau năm 2009, nhiều bằng sáng chế về in 3D hết hạn bảo vệ bản quyền. Lĩnh vực này lập tức thu hút nhiều nhà sản xuất tham gia nghiên cứu và đầu tư, tạo ra sự biến động lớn trên thị trường và làm giảm giá thành sản xuất. Từ đó, in 3D trở thành một trong những chìa khóa công nghệ tạo cơ hội cho những sáng chế mới ra đời, mở ra một thời kỳ phát triển mạnh mẽ của ngành công nghiệp này trong rất nhiều lĩnh vực của đời sống, đặc biệt là y tế. Việc chế tạo các bộ phận cơ thể hay mô nhân tạo để cấy ghép và phục hình bằng cách in 3D đã thực sự làm nên cuộc cách mạng trong lĩnh vực y -sinh. Phương pháp này đã được nghiên cứu thành công trong phẫu thuật, điều trị bỏng, ghép mạch máu và một số trường hợp khác [3], [2], [4].
Trong công nghệ dược phẩm, nghiên cứu về thuốc in 3D lần đầu tiên được công bố vào năm 1996 giới thiệu một yếu tố mới trong sản xuất đó là ứng dụng kỹ thuật số để kết hợp và sắp xếp các thành phần trong dạng bào chế. Đây là bước tiến quan trọng trong nghiên cứu phát triển thuốc, có thể tạo ra những tác động tích cực vào quá trình giải phóng dược chất khỏi thuốc. So với các kỹ thuật truyền thống,sự khác biệt của công nghệ in 3D là có tiềm năng tạo ra các sản phẩm phức tạp, cá thể hóa và sản xuất theo yêu cầu. Các chế phẩm phức tạp có thể kết hợp tối ưu nhiều thành phần, thay đổi cơ chế hoặc cách thức giải phóng dược chất. Những chế phẩm được cá thể hóa có thể làm giảm tác dụng không mong muốn và đơn giản hóa các phương pháp điều trị, đặc biệt thích hợp với trẻ em và người già. Những chế phẩm sản xuất theo yêu cầu mở rộng cơ hội sử dụng cho các loại thuốc mới, các thuốc cấp cứu và các thuốc có độ ổn định kém. Các sản phẩm này làm thay đổi tương tác thuốc và bệnh nhân, từ đó cải thiện sự tuân thủ và tăng hiệu quả điều trị của thuốc [4].
Ứng dụng công nghệ in 3D trong nghiên cứu, sản xuất thuốc
Bào chế viên giải phóng nhanh (fast release)
Ngày 3 tháng 8 năm 2015, Cục quản lý Thực phẩm và Dược phẩm Mỹ đã phê chuẩn thuốc Spritam của công ty dược Aprecia. Sản phẩm này hiện đã được sử dụng rộng rãi để chống động kinh. Spritam được in 3D bằng phương pháp đông rắn bột bằng tá dược dính lỏng (DOS). Viên thuốc hòa tan gần như ngay lập tức khi thả vào nước, thích hợp với những bệnh nhân bị chứng khó nuốt, hiện tượng này thường gặp ở những bệnh nhân động kinh.
Fina F. và cộng sự nghiên cứu bào chế viên nén paracetamol rã nhanh trong miệng bằng phương pháp SLS (selective laser sintering – Hóa lỏng chất rắn bằng tia laser chọn lọc) với các tá dược hydroxypropylmethyl cellulose (HPMC), methyl cellulose (MC), vinylpyrolidon-vinyl acetat copolyme (Kolidon VA64). Viên thuốc rã trong vòng 4 giây và hòa tan hơn 90 % sau 5 phút [5].

Ehtezazi T. và cộng sự nghiên cứu bào chế màng phim tan nhanh trong miệng chứa dược chất paracetamol và ibuprofen với các tá dược polyethylen oxid (PEO) và alcol polyvinic (PVA) bằng phương pháp đùn nóng chảy. Màng 1 lớp có độ dày 197 ± 21 μm và hòa tan sau 42 ± 7 giây. Màng 2 lớp có độ dày 298 ± 15 μm và hòa tan sau 48 ± 5 giây [4].

Jamróz W. và cộng sự nghiên cứu bào chế màng hòa tan trong miệng chứa aripirazol và PVA bằng phương pháp đùn nóng chảy. Do dược chất chuyển sang dạng vô định hình sau quá trình đùn nên tốc độ hoà tan dược chất từ dạng thuốc tăng đáng kể, aripiraziol hòa tan trên 90 % sau 15 phút [6].
Bào chế viên giải phóng kéo dài
Viên dạng cốt chứa sáp ong và fenofibrat đã được Kyobula bào chế bằng phương pháp DOD với cấu trúc tổ ong và dược chất lấp đầy các khoang rỗng. Sản phẩm nghiên cứu giải phóng dược chất kéo dài đến 12 giờ. Đồ thị giải phóng dược chất chỉ ra rằng, đường kính các khoang rỗng tổ ong và tính thấm của vật liệu ảnh hưởng đến tốc độ và mức độ hòa tan dược chất từ dạng thuốc [7]. Điều này cho thấy, có thể sản xuất các loại thuốc cá thể hóa khi sử dụng kết hợp với các vật liệu khác nhau có hình dạng khác nhau.

Chai X. và cộng sự nghiên cứu bào chế viên nổi giải phóng kéo dài domperidon bằng phương pháp đùn nóng chảy với các tá dược hydroxypropyl cellulose và bari sulfat. Viên nghiên cứu được đánh giá sinh khả dụng trên thỏ, kết quả cho thấy viên thuốc có thể nổi trong dạ dày khoảng 10 giờ, Tmax kéo dài gấp 3 lần và nồng độ thuốc trong máu cao gấp đôi so với viên trên thị trường [8].

Clark E. và cộng sự đã nghiên cứu khả năng ứng dụng polyme quang hóa trong sản xuất thuốc bằng phương pháp in lập thể, viên thuốc chứa ropinirol hydroclorid, polyethylen glycol diacrylat (PEGDA) và Irgacure 2959 được bào chế trong môi trường có hàm lượng oxy thấp. Liên kết ngang của các polyme nhạy cảm với tia cực tím tạo ra ropinirol hydroclorid vô định hình phân tán trong polyme. Dược chất giải phóng liên tục từ dạng thuốc trong vòng 6 giờ. Thử nghiệm cho thấy, các vật liệu tạo cốt giải phóng kéo dài đã sử dụng phù hợp với phương pháp in lập thể [9].

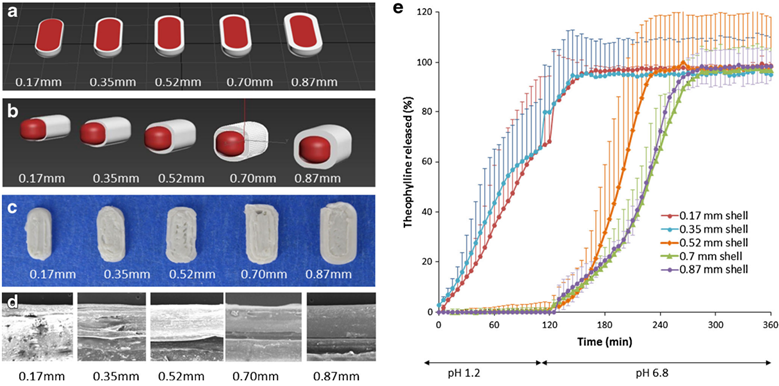
Okwuosa T. C., và cộng sự bào chế viên theophylin giải phóng chậm với cơ chế kháng dịch vị dạ dày bằng phương pháp đùn nóng chảy. Các tá dược sử dụng trong nghiên cứu bao gồm: PVP 110, Eudragit L100. Sản phẩm nghiên cứu có cấu trúc nhân-vỏ, do lớp vỏ chắc chắn và không có khiếm khuyết nên sản phẩm kháng acid dịch vị rất tốt [10].
Kết luận
Công nghệ in 3D ứng dụng trong chẩn đoán, điều trị và sản xuất các dạng thuốc và thiết bị y tế được công nhận là một biện pháp hữu hiệu để tạo ra các sản phẩm tùy chỉnh, phù hợp với mục đích điều trị trên từng cá thể bệnh nhân, đặc biệt là những đối tượng người già và trẻ em.
Các nhà khoa học đã bào chế thuốc dựa trên công nghệ này với các phương pháp như đông rắn từ bột, đông rắn từ chất lỏng và đùn ép để tạo ra những sản phẩm giải phóng dược chất theo yêu cầu (nhanh, kéo dài hoặc có kiểm soát hay tại đích… ). Điều này cho thấy, công nghệ in 3D hứa hẹn đem lại những đột phá mới trong nghiên cứu xây dựng công thức thuốc do có thể tạo ra các dạng bào chế khác nhau với độ chính xác cao của tỷ lệ dược chất và tá dược theo cách hoàn toàn mới so với sản xuất dược phẩm truyền thống.
Tài liệu tham khảo
- Lamichhane S.,(2019),“Complex formulations,simple techniques:Can3Dprintingtechnologybe the Midastouch in pharmaceutical industry?”Asian Journal of Pharmaceutic Sciense, Available online 14 February 2019, https://www.sciencedirect.com/science/article/pii/S1818087618307852.
- Jamróz W., (2018), “3D Printing in Pharmaceutical and Medical Applications – Recent Achievements and Challenges”, Pharmaceutical research, pp. 35-76
- Bracaglia LG., ( 2017), “Printed pericardium hydrogels to promote wound healing in vascular applications”, Biomacromolecules, Vol. 18, pp. 3802–3811.
- Norman J., (2017),“A new chapter in pharmaceutical manufacturing: 3D-printed drug products”, Advanced Drug Delivery Reviews, pp. 39–50.
- Fina F., (2018),“Fabricating 3D printed orally disintegrating printlets using selective lasersinterin”, International Journal of Pharmaceutics, V 541, pp. 101-107.
- Ehtezazi T., Algellay, M., Islam,Y. et al. (2018).“The application of 3D print- ing in the formulation of multilayered fast dissolving oral films”.Journal of Pharmaceutical Sciences, Vol. 107, pp. 1076-1085.
- Jamróz W., (2017), “3D printed orodispersible films with aripiprazole”, International Journal of Pharmaceutics, Vol. 533(2), pp. 413–20.
- Chai X., (2017), Fused deposition modeling (FDM),“3D printed tablets for intragastric floating delivery of domperidone”, Scientificreport 7, https://www.nature.com/articles/s41598-017- 03097-x.
- Clark E. A., (2017), “3D printing of tablets using inkjet with UV photoinitiation”, International Journal of Pharmaceutics, Vol. 529, pp. 523-530.
- Okwuosa T. C., (2017), Fabricating a Shell-Core Delayed Release Tablet Using Dual FDM 3D Printing for Patient-Centred Therapy, Pharmaceutical research, Vol. 24, pp. 427-437.
BỘ MÔN HÓA DƯỢC – HÓA HỮU CƠ – HÓA HỌC






